
Loxia Studio
Páginas
SCM Music Player
quarta-feira, 31 de agosto de 2016
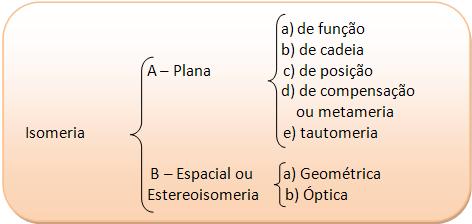
ENEM 2016 - Isomeria Plana
Isômeros se definem como substâncias diferentes que apresentam a mesma fórmula molecular, mas se diferem em alguns aspectos.
A Isomeria plana aborda os isômeros através do estudo de suas fórmulas estruturais planas.
Vejamos os cinco tipos de Isomeria plana:
• Isomeria de Função: os isômeros possuem mesma fórmula molecular, mas pertencem a funções diferentes. Essa isomeria ocorre principalmente com alcoóis e éteres, aldeídos e cetonas, ácidos carboxílicos e ésteres. Exemplo:
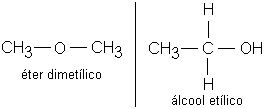
Éter dimetílico e álcool etílico possuem a mesma fórmula molecular: C2H6O, mas pertencem a diferentes funções:
Éteres: compostos que apresentam Oxigênio (O) localizado entre carbonos.
Alcoóis: apresentam grupo (-OH) ligado a carbono saturado.
• Isomeria de Posição: os isômeros possuem o mesmo tipo de cadeia e pertencem à mesma função, mas apresentam diferença na posição de um grupo funcional, de uma insaturação ou de uma ramificação.
Exemplos:
Isômeros xilenos (orto, meta e para).
C8H16
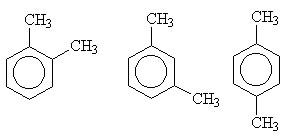
As três estruturas apresentam diferença na posição dos grupos - CH3 (ramificações).

1-pentino e 2-pentino possuem mesma fórmula molecular: C5H8O. A diferença entre os isômeros está na insaturação (ligação tripla), indicada pelos algarismos 1 e 2.
• Isomeria de Cadeia: os isômeros pertencem à mesma função, mas apresentam diferentes tipos de cadeia.
H2C = CH – CH3 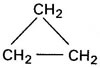

cadeia aberta cadeia fechada
Propeno e Ciclopropano possuem mesma fórmula molecular (C3H6) e pertencem à mesma função (hidrocarbonetos), mas se diferem no tipo de cadeia.
Propeno – cadeia aberta (alifática)
Ciclopropano – cadeia fechada (cíclica)
• Metameria: ou Isomeria de Compensação. Os isômeros pertencem à mesma função, apresentam o mesmo tipo de cadeia, mas se diferem na posição do heteroátomo. Heteroátomo: átomo diferente de carbono presente nas cadeias carbônicas. Exemplo:
C4H11N
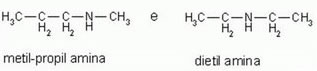
A fórmula molecular C4H11N é a mesma para ambas as cadeias, elas também pertencem à mesma função (Amina), porém o diferencial está na posição do heteroátomo: N (Nitrogênio). Na metil-propil amina, o nitrogênio se posiciona na extremidade da cadeia e na dietil amina está centralizado.
• Tautomeria: também conhecida por Isomeria dinâmica, nela os isômeros pertencentes a funções químicas diferentes estabelecem um equilíbrio químico dinâmico em solução.
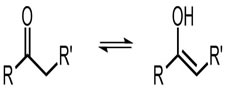
Cetona Enol
Pode-se dizer que os compostos cetona e enol, apesar de pertencerem a funções químicas diferentes, são isômeros (tautômeros).
ENEM 2016 - Isomeria Espacial A isomeria espacial faz uma análise espacial da molécula, ela é dividida em: isomeria geométrica e isomeria óptica.
Isômeros espaciais são compostos que possuem a mesma fórmula molecular, mas se diferem na fórmula estrutural. Só é possível perceber a diferença através da análise espacial da molécula.
Existem dois tipos de isomeria espacial: geométrica e óptica.
• Isomeria geométrica: análise da posição dos átomos num plano imaginário (tridimensional). Os ácidos maleico e fumárico são classificados como isômeros geométricos em razão de suas estruturas espaciais:
.jpg)
Os isômeros possuem a mesma fórmula molecular como também a mesma fórmula estrutural plana, a diferença está na posição das ramificações – COOH: no isômero cis elas se posicionam do mesmo lado e no isômero trans, ocupam lados opostos.
O prefixo “Cis” pode ser representado pela letra Z e “Trans” pela letra E. Desta forma temos: Z- butenodioico e E- butenodioico.
• Isomeria óptica: estuda o comportamento das substâncias submetidas a um feixe de luz polarizada. Algumas substâncias têm a propriedade de desviar o plano de vibração da luz, elas são, por isso, denominadas de isômeros ópticos.
Para entender a Isomeria óptica atente-se para o estudo da luz. A luz emitida por uma lâmpada incandescente é constituída de ondas eletromagnéticas, que se propagam com vibrações em infinitos planos, formando um movimento espiralado. Se essas vibrações passarem por um filtro, teremos então a luz polarizada: vibração em apenas um plano.
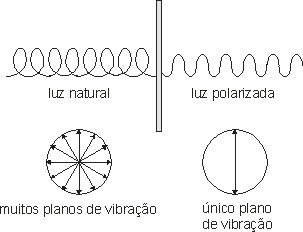
* Os aparelhos capazes de fazer essa conversão são denominados de polarizadores.
Imaginemos duas moléculas frente ao espelho (ilustrado por um traço):
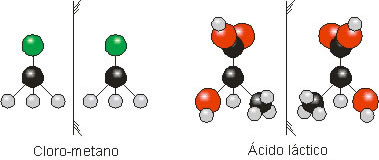
Repare que as moléculas de Cloro-metano são sobreponíveis (se sobrepõe), ou seja, a imagem refletida no espelho é exatamente igual (objeto = imagem). Já a molécula de Ácido láctico tem seu reflexo no espelho de forma invertida, as imagens não são sobreponíveis (objeto ≠ imagem). Trata-se dos isômeros ácido l-láctico e ácido d-láctico.
Essa análise é muito importante, uma vez que os aspectos fisiológicos destes isômeros se diferenciam. O ácido l-láctico é produto da fermentação de açúcares e o d-lático está presente nos músculos.
Só é possível detectar a diferença destes isômeros quando os mesmos são submetidos a um feixe de luz polarizada: eles desviam o plano de vibração da luz.
http://mundoeducacao.bol.uol.com.br/quimica/isomeria-espacial.htm
ENEM 2016 - someria A isomeria é o fenômeno em que substâncias químicas com propriedades diferentes apresentam a mesma fórmula molecular.
A isomeria começou a ser considerada em 1823 quando os químicos Liebeg e Wohler criaram, respectivamente, o isocianato de prata (AgONC) e o cianato de prata (AgOCN). Quando o químico alemão Friedrich Wohler (discípulo do químico sueco Jons Jacob Berzelius) realizou a síntese da ureia a partir da amônia, a isomeria foi confirmada:
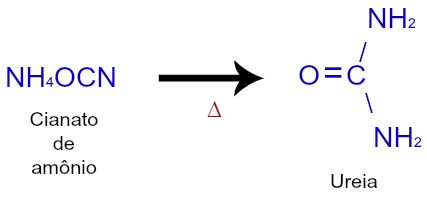
Síntese da ureia a partir do aquecimento do cianato de amônio
Com essa síntese, Wohler observou que tanto a ureia quanto o cianato de amônio apresentavam os mesmos constituintes químicos, ou seja, a mesma fórmula molecular. Com essa observação, surgiu a definição de isomeria:
“Isomeria é um fenômeno natural em que duas ou mais substâncias diferentes apresentam a mesma fórmula molecular.”
O estudo da isomeria é dividido em duas grandes áreas:
- Isomeria plana ou constitucional;
- Isomeria espacial ou estereoisomeria.
a) Isomeria plana ou constitucional
É a isomeria em que os compostos apresentam a mesma fórmula molecular, mas fórmulas estruturais planas diferentes. Esse fenômeno origina substâncias completamente diferentes em relação às propriedades físicas e químicas. Os tipos de isomeria plana são:
- Isomeria plana de função: os isômeros pertencem a diferentes funções;
- Isomeria plana de cadeia: os isômeros pertencem à mesma função, mas apresentam cadeias planas com características diferentes;
- Isomeria plana de posição: os isômeros pertencem à mesma função, a mesma caraterística de cadeia, mas diferem quanto à posição de algum grupo (ramificação, insaturação ou grupo funcional);
- Isomeria plana por metameria: os isômeros pertencem à mesma função, possuem a mesma caraterística de cadeia, mas diferenciam-se quanto à posição de um heteroátomo;
- Isomeria plana por tautomeria: tipo especial de isomeria que ocorre entre um enol e um aldeído ou entre um enol e uma cetona.
b) Isomeria Espacial ou Estereoisomeria
É a parte da isomeria que analisa as posições de cada um dos ligantes de um isômero no plano espacial. Assim, podemos ter duas moléculas da mesma substância, mas com ligantes em posições diferentes no espaço. Há dois tipos de isomeria espacial:
- Isomeria geométrica: Ocorre em moléculas em que dois dos carbonos de uma cadeia aberta ou fechada não apresentam rotação em seus eixos. Assim, os seus ligantes sempre ocupam planos fixos no mesmo plano ou em planos diferentes. Essa isomeria é diferenciada por meio de dois sistemas de nomenclatura:
Cis-trans (os carbonos apresentam ligantes iguais)
E-Z os carbonos apresentam ligantes diferentes entre si)
- Isomeria óptica: É a isomeria presente em moléculas que apresentam carbono assimétrico ou quiral. Por essa razão, não é possível dividir a estrutura em duas partes iguais. Os isômeros ópticos apresentam a capacidade de polarizar e desviar o plano da luz. Eles podem ser chamados de:
Isômeros ativos (antípodas ópticas)
Isômeros inativos (mistura racêmica)
Isômeros meso
Diastereoisômeros
URCA RECEBE PEDIDOS DE ISENÇÃO DO VESTIBULAR 2017 A PARTIR DE ONTEM (30)

A Universidade Regional do Cariri (URCA), no Ceará, iniciou nesta terça-feira, 30 de agosto, o prazo para pedidos de isenção da taxa do Vestibular 2017/1. As solicitações podem ser feitas até 4 de setembro.
A gratuidade da taxa será concedida por categorias, as quais são:
A- Servidor público estadual do Ceará;
B- Cônjuge, filhos ou dependentes legais de servidores da URCA;
C- Doador de sangue;
D- Candidato que cursou os três anos do ensino médio em escolas públicas, ou pela Educação de Jovens e Adultos;
E- Candidato de baixa-renda;
F- Candidato portador de necessidades especiais.
Os vestibulandos devem acessar o Edital e verificar a documentação necessária para cada categoria. Os documentos precisam ser entregues nas cidades de Campos Sales, Crato, Iguatu e Missão Velha.
Resultado
Os beneficiados serão conhecidos em 19 de setembro. Recursos serão aceitos até 21 do mesmo mês. A versão final estará disponível em 22 seguinte.
Os isentos não estarão automaticamente inscritos no Vestibular. Mais informações no Edital de isenção.
Vestibular Brasil Escola
ENEM 2016 - Entenda o que a prova do Enem espera de você
Saiba o que são os eixos cognitivos e como eles aparecem no exame
Quando você vai prestar um vestibular, sabe de antemão que será cobrado pela matéria que aprendeu na escola durante o Ensino Médio. E no Exame Nacional do Ensino Médio (Enem) não é diferente: o que é cobrado na prova é o conteúdo que você aprendeu na escola. Mas o Enem cobra esse conteúdo de uma forma própria, com a sua “cara”. O exame é focado na compreensão do estudante em relação ao que lê e em sua capacidade de raciocínio.

A base do Enem está descrita na Matriz de Referência do exame, elaborada pelo Ministério da Educação (MEC), que tem como espinha dorsal as cinco competências que se espera de todos os estudantes:
1. Dominar linguagens;
2. Compreender e interpretar fenômenos;
3. Solucionar problemas;
4. Construir argumentação;
5. Elaborar propostas.
A seguir, exemplificamos o que são essas competências, com base em questões do Enem 2014. Na prática, cada questão da prova pode avaliar o domínio de uma ou mais competências. Escolhemos questões que possuem predominantemente uma das cinco competências.
Competência 1: Dominar linguagens
O primeiro eixo prevê “dominar a norma culta da Língua Portuguesa e fazer uso das linguagens matemática, artística e científica e das línguas espanhola e inglesa”. Ou seja: a palavra “linguagem” é usada aqui em sentido amplo, não se restringindo apenas à escrita. Inclui também a compreensão de diagramas, gráficos, ilustrações, quadrinhos, pinturas, charges etc.
Quer dizer, não basta simplesmente juntar as palavras ou símbolos: é preciso compreender a mensagem. A capacidade de leitura e compreensão é a principal característica do Enem. Veja como ela aparece numa questão.
QUESTÃO DE CIÊNCIAS HUMANAS

Na charge, identifica-se uma contradição no retorno de parte dos “Voluntários da Pátria” que lutaram na Guerra do Paraguai (1864-1870), evidenciada na
a) negação da cidadania aos familiares cativos.
b) concessão de alforrias aos militares escravos.
c) perseguição dos escravistas aos soldados negros.
d) punição dos feitores aos recrutados compulsoriamente.
e) suspensão das indenizações aos proprietários prejudicados.
O que o Enem espera com essa questão: aqui é importante que você entenda o que a ilustração e o texto, em conjunto, expressam. O primeiro passo é observar atentamente a imagem: um militar condecorado e recém-chegado – note seu uniforme e a mochila ainda nas costas – que expressa angústia ao ver ao fundo uma mulher negra amarrada a um tronco sendo chicoteada.
O texto explicita a contradição: o mesmo militar que teria enfrentado perigos em terras estrangeiras e “libertado um povo da escravidão” – no caso, os paraguaios –, regressa ao Brasil e encontra sua família ainda escravizada, sem liberdade e sem direitos. Portanto, a resposta a é a correta: a charge evidencia a falta de cidadania em que se encontra a família do voluntário.
Competência 2: Compreender fenômenos
Esse eixo avalia a capacidade de “construir e aplicar conceitos das várias áreas do conhecimento para a compreensão de fenômenos naturais, de processos histórico-geográficos, da produção tecnológica e das manifestações artísticas”.
Em outras palavras, espera-se que o aluno utilize seu conhecimento das diferentes áreas do estudo de forma combinada para entender os acontecimentos e o mundo que o cerca. Veja um exemplo.
QUESTÃO DE MATEMÁTICA
Um executivo sempre viaja entre as cidades A e B, que estão localizadas em fusos horários distintos. O tempo de duração da viagem de avião entre as duas cidades é de 6 horas. Ele sempre pega um voo que sai de A às 15h e chega à cidade B às 18h (respectivos horários locais).
Certo dia, ao chegar à cidade B, soube que precisava estar de volta à cidade A, no máximo, até as 13h do dia seguinte (horário local de A).
Para que o executivo chegue à cidade A no horário correto e admitindo que não haja atrasos, ele deve pegar um voo saindo da cidade B, em horário local de B, no máximo à(s)
a) 16h.
b) 10h.
c) 7h.
d) 4h.
e) 1h.
Essa questão mostra como a matemática é aplicada no dia a dia. Trata-se de alguém que viaja entre regiões com fusos horários diferentes. Para resolver o problema, você precisa entender o que o texto diz: se o homem sai da cidade A às 15h e a viagem dura seis horas, ele deveria chegar às 21h na cidade B. Mas o texto diz que ele chega sempre às 18h. Ou seja, com uma simples conta de subtração (21 – 18) podemos concluir que a diferença de fuso entre as duas cidades é de 3 horas.
Com isso em mente, quando na cidade A for 13h (horário esperado de chegada, segundo o exercício), será 10h em B, certo? Esse raciocínio simplifica a conta, porque precisamos considerar apenas o horário local em B e o fato da viagem durar seis horas: 10 – 6 = 4. Concluímos, então, que o homem precisa sair às 4h de B para chegar às 13h (horário local de A). A resposta correta é a letra d.
Competência 3: Enfrentar situações-problema
O terceiro eixo do Enem espera que você possa “selecionar, organizar, relacionar, interpretar dados e informações representados de diferentes formas, para tomar decisões e enfrentar situações-problema”. Saiba como isso ocorre na prática:
QUESTÃO DE CIÊNCIAS DA NATUREZA
É comum aos fotógrafos tirar fotos coloridas em ambientes iluminados por lâmpadas fluorescentes, que contêm uma forte composição de luz verde. A consequência desse fato na fotografia é que todos os objetos claros, principalmente os brancos, aparecerão esverdeados. Para equilibrar as cores, deve-se usar um filtro adequado para diminuir a intensidade da luz verde que chega aos sensores da câmera fotográfica. Na escolha desse filtro, utiliza-se o conhecimento da composição das cores-luz primárias: vermelho, verde e azul; e das cores-luz secundárias: amarelo = vermelho + verde, ciano = verde + azul e magenta = vermelho + azul.
Disponível em: http://nautilus.fis.uc.pt. Acesso em 20 maio 2014 (adaptado).
Na situação descrita, qual deve ser o filtro utilizado para que a fotografia apresente as cores naturais dos objetos?
a) Ciano.
b) Verde.
c) Amarelo.
d) Magenta.
e) Vermelho.
Você pode até não entender de fotografia, mas se ler atentamente as informações, conseguirá chegar à resposta. Você já sabe que o problema é o excesso de luz verde. Também pode notar que o verde é uma cor-luz primária, ao lado do vermelho e do azul. Portanto, para conseguir uma fotografia com cores naturais, seria interessante compensar o excesso do verde aumentando as outras duas cores primárias – pois, se aumentarmos apenas uma delas, a foto continuará com aspecto distorcido de cores. Isso é possível se optarmos pelas cores-luz secundárias já que, de acordo com o texto, elas são sempre derivadas da mistura de duas das três cores-luz primárias.
De todas elas, a única que não possui verde em sua composição é a magenta (vermelho + azul). Por isso, ao utilizar um filtro magenta, haverá um balanceamento das cores vermelho e azul com o verde apresentado pelas lâmpadas fluorescentes e, portanto, a resposta d é a correta.
Competência 4: Construir argumentação
Esse eixo exige que o estudante seja capaz de “relacionar informações, representadas em diferentes formas, e conhecimentos disponíveis em situações concretas, para construir argumentação consistente”.
Assumir um ponto de vista e defendê-lo com argumentos são habilidades esperadas não só para a redação, como também para algumas questões objetivas. Veja como ela apareceu no exame:
QUESTÃO DE CIÊNCIAS HUMANAS
TEXTO I
O presidente do jornal de maior circulação do país destacava também os avanços econômicos obtidos naqueles vinte anos, mas, ao justificar sua adesão aos militares em 1964, deixava clara sua crença de que a intervenção fora imprescindível para a manutenção da democracia.
Disponível em: http://oglobo.globo.com. Acesso em: 1 set. 2013 (adaptado).
TEXTO II
Nada pode ser colocado em compensação à perda das liberdades individuais. Não existe nada de bom quando se aceita uma solução autoritária.
FICO, C. A educação e o golpe de 1964. Disponível em: www.brasilrecente.com. Acesso em: 4 abr. 2014 (adaptado).
Embora enfatizem a defesa da democracia, as visões do movimento político-militar de 1964 divergem ao focarem, respectivamente:
a) Razões de Estado – Soberania popular.
b) Ordenação da Nação – Prerrogativas religiosas.
c) Imposição das Forças Armadas – Deveres sociais.
d) Normatização do Poder Judiciário – Regras morais.
e) Contestação do sistema de governo – Tradições culturais.
Esta é uma questão interessante, pois envolve dois pontos de vista distintos sobre o mesmo assunto: a defesa da democracia. Ambos os textos fazem referência ao golpe mileitar de 1964, que culminou em uma ditadura de 21 anos. No caso do primeiro, é a justificativa dada por um jornal sobre seu apoio aos militares. Teria sido a medida encontrada para garantir a democracia no país frente à maneira com que o presidente João Goulart estava conduzindo a nação – no caso, com medidas populistas consideradas de esquerda pelo jornal.
Quanto ao segundo texto, ele considera a democracia como uma conquista social inegociável, à qual não podem ser feitas concessões. Portanto, como o primeiro argumento faz referência a questões de Estado e o segundo a questões sociais, a resposta correta é a letra a.
Competência 5: Elaborar propostas
O último eixo diz respeito a “recorrer aos conhecimentos desenvolvidos na escola para elaboração de propostas de intervenção solidária na realidade, respeitando os valores humanos e considerando a diversidade sociocultural”. Muito importante na redação, também aparece em questões objetivas, como a que está a seguir.
QUESTÃO DE LINGUAGENS E CÓDIGOS

Os meios de comunicação podem contribuir para a resolução de problemas sociais, entre os quais o da violência sexual infantil. Nesse sentido, a propaganda usa a metáfora do pesadelo para
a) informar crianças vítimas de abuso sexual sobre os perigos dessa prática, contribuindo para erradicá-la.
b) denunciar ocorrências de abuso sexual contra meninas, com o objetivo de colocar criminosos na cadeia.
c) dar a devida dimensão do que é o abuso sexual para uma criança, enfatizando a importância da denúncia.
d) destacar que a violência sexual infantil predomina durante a noite, o que requer maior cuidado dos responsáveis nesse período.
e) chamar a atenção para o fato de o abuso infantil ocorrer durante o sono, sendo confundido por algumas crianças com um pesadelo.
Uma metáfora é uma figura de linguagem em que uma parte substitui outra em uma relação de semelhança, produzindo sentidos figurados por meio de comparações implícitas. No caso dessa questão, essa figura de linguagem aparece vinculada a uma campanha de alerta sobre a violência sexual infantil. Ao relacionar um desenho infantilizado de um monstro à mensagem “para algumas crianças o pesadelo chega antes do sono”, o autor da campanha usa a metáfora do pesadelo, sempre algo ruim, para se referir à gravidade de um abuso. Por fim, enfatiza também a importância da denúncia, uma proposta de como enfrentar o problema, como bem assinala a resposta correta c.
GUIA DO ESTUDANTE
segunda-feira, 29 de agosto de 2016
UNIFESP ANUNCIA 340 VAGAS EM VESTIBULAR MISTO 2017 PARA PARTICIPANTES DO ENEM - Inscrições serão feitas de 19 de setembro a 21 de outubro. Edital já está disponível.

A Universidade Federal de São Paulo (Unifesp) anunciou a oferta de 340 vagas no Vestibular Misto 2017. A seleção é exclusiva para participantes do Exame Nacional do Ensino Médio (Enem) 2016 e terá inscrições de 19 de setembro até 21 de outubro com taxa de R$ 129.
Das 340 vagas, 171 são destinadas aos cotistas. As oportunidades da Unifesp são para os cursos de Ciências Biológicas (Bacharelado) e Modalidade Médica, Engenharia Química, Fonoaudiologia e Medicina.
Além do Vestibular Misto, a Unifesp também preencherá oportunidades pelo Sistema de Seleção Unificada (SiSU). O número de vagas é informado em edital específico. A oferta também é exclusiva para participantes do Enem.
Isenção
O prazo para os pedidos de isenção da taxa continua aberto até 31 de agosto. O benefício é exclusivo para estudantes de escolas públicas ou bolsistas integrais em colégios particulares.
Há duas opções para concorrer à gratuidade. Estar inscrito no Cadastro Único Para Programas Sociais do Governo Federal (CadÚnico), no qual a conferência dos dados é feita pelo Número de Inscrição Social (NIS). Outra forma é comprovar renda familiar per capita mensal de até 1,5 salário mínimo.
Os isentos serão conhecidos em 9 de setembro. Os beneficiados deverão se inscrever de forma normal no Vestibular.
Seleção
O Vestibular Misto é composto pela soma das notas do Enem 2016 e da prova tradicional aplicada pela universidade. Os locais da seleção serão divulgados a partir de 21 de novembro.
A prova tradicional será aplicada em 15 e 16 de dezembro, das 14h às 18h. A seleção será constituída de questões de Língua Portuguesa, Língua Estrangeira, Conhecimentos Específicos e uma Redação.
Resultado
O resultado será publicado em 30 de janeiro e as matrículas serão feitas em 13 e 14 de fevereiro. A segunda chamada é esperada para 16 seguinte.
A declaração de interesse por vaga será será recebida entre 16 e 21 de fevereiro. Quatro convocações serão feitas a partir da manifestação, as quais terão listas divulgadas em 23 do mesmo mês e 7, 14 e 21 de março.
Vestibular Brasil Escola
ALBERT EISTEIN ABRE INSCRIÇÕES DO VESTIBULAR 2017 DE MEDICINA E ENFERMAGEM - Notas do Enem podem ser usadas como parte da pontuação. Prazo acaba em 7 de outubro

O Albert Eistein Instituto Israelita de Ensino e Pesquisa abriu as inscrições do Vestibular 2017 nesta segunda-feira, 29 de agosto. O prazo segue até 7 de outubro e a taxa é de R$ 160.
O processo seletivo é organizado pela Pontifícia Universidade Católica de São Paulo (PUC-SP) e as inscrições são feitas pelo site da instituição.
Enem
Os candidatos que desejarem poderão utilizar as notas do Exame Nacional do Ensino Médio (Enem) 2016, informando tal opção ao se inscreverem.
Seleção
Os locais de prova da 1ª fase serão conhecidos em 27 de outubro. Esta etapa será aplicada em 15 de novembro, a partir das 14h. As provas serão compostas por 50 questões objetivas sobre conhecimentos gerais, seis analítico-dissertativas e uma redação.
Resultados
Os aprovados para Enfermagem serão convocados de 16 a 21 de dezembro. Já a segunda chamada é esperada para período entre 3 e 5 de janeiro. Outras quatro chamadas serão feitas no mês.
Já os classificados na primeira fase de Medicina serão conhecidos em 16 de dezembro (sem a nota do Enem), enquanto com a nota do exame o resultado sairá em 9 de janeiro.
Apenas os candidatos de Medicina contam com uma segunda fase, a qual é constituída de Múltiplas Mini Entrevistas (MME). Os vestibulandos aptos serão conhecidos em 17 de janeiro, enquanto esta etapa será aplicada em 22 seguinte.
A primeira chamada de Medicina será divulgada entre 6 e 9 de fevereiro. Outras três convocações serão feitas até o fim do mês.
Oportunidades
A Eistein oferece 50 vagas para Medicina e 60 em Enfermagem. Mais informações no Manual do Candidato.
Vestibular Brasil Escola
Vestibular Brasil Escola
sábado, 27 de agosto de 2016
ENEM 2016 - DESSALINIZAÇÃO DA ÁGUA
Dessalinização é um processo físico-químico de retirada de sais da água, tornando-a doce e própria para o consumo.
Como se sabe, a notícia de que pode faltar água potável no planeta é tenebrosa ao homem, já existem regiões ameaçadas, as Ilhas são exemplos: Ilha de Chipre, Ilha de Páscoa, Ilha Fernando de Noronha, onde os lençóis freáticos diminuíram em razão da exploração. Em alguns países, como a Arábia Saudita e Israel, este já é um problema.
Então por que não transformar água salgada presente em abundância nestes locais em água doce? Esta é a ideia que pode solucionar este problema ambiental, vejamos os possíveis processos para a dessalinização da água:
Evaporação: a água salgada é colocada em um tanque com fundo preto e teto de vidro transparente, este tanque permite que o calor do sol evapore a água.
Observe a figura que ilustra o processo descrito acima:
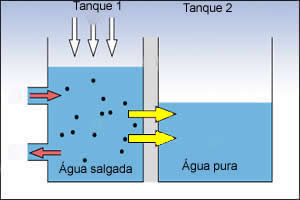
1. A água salgada é retirada do mar e transferida para o tanque 1 (setas vermelhas);
2. A luz solar incidente (parte superior do tanque: indicada pelas setas brancas), faz com que a água salgada se evapore;
3. O vapor de água passa por um resfriamento e se converte em líquido por condensação: o processo é representado pelas setas amarelas. O produto líquido é a água já no estado puro, esta é recolhida por canaletas e então armazenada no tanque 2.
O processo é simples e barato, o grande problema é que os tanques ocupam extensas áreas e estas precisam receber iluminação solar satisfatória para que a evaporação ocorra com sucesso.
Osmose reversa:
Também conhecida como Osmose Inversa, é onde se exerce forte pressão em uma solução salina. Como o próprio nome já diz, esse processo é o inverso da osmose natural (passagem de uma substância pura para uma solução através de uma membrana semipermeável). Só que para dessalinizar a água é preciso que esta passagem ocorra inversamente: da solução (água e sal) para água pura. Não entendeu? É fácil! O processo consiste em realizar a passagem da água salgada por membranas de fibra oca. Estas fibras contêm poros microscópicos e todo o sal e impurezas presentes na água ficam retidas nestes pequenos poros.
Repare que, ao contrário da osmose comum, a reversa consiste na transferência de uma solução salgada para uma purificada. Este método é o que apresenta perspectivas para a solução da água, atualmente já existem usinas operantes no Golfo Pérsico, Espanha, Malta, Austrália e Caribe convertendo 4,8 bilhões de metros cúbicos de água salgada em água doce, por ano.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
ENEM 2016 - Pressão osmótica
A osmose é a passagem de solvente (geralmente a água) por uma membrana semipermeável para um meio mais concentrado. Já a pressão osmótica é a pressão que deve ser exercida sobre um sistema para evitar que a osmose ocorra.
Por exemplo, observe o tubo em U apresentado a seguir. Do lado esquerdo, há somente água pura, e, do lado direito, há uma solução. Elas estão separadas por uma membrana semipermeável. Com o tempo, a osmose começa a ocorrer e o solvente do lado esquerdo começa a passar para a solução do lado direito até que a altura da solução exerce uma pressão sobre a membrana que impede que o solvente continue passando por ela, por essa razão, a osmose para. Essa pressão é a pressão osmótica.
.jpg)
Osmose ocorrendo em tubo em U
Se quiséssemos que essa osmose não tivesse nem ao menos começado, era só ter exercido, no início, uma pressão sobre o lado direito do tubo (sobre a solução) com intensidade igual à pressão osmótica para a solução em questão. Desse modo, o fluxo de solvente ficaria impedido e a osmose não ocorreria, como está sendo feito na imagem a seguir:
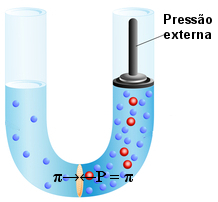
Pressão osmótica aplicada para impedir osmose
Quanto mais concentrada for a solução ou quanto maior for a diferença de concentração entre as duas soluções que estão separadas por uma membrana semipermeável, maior será a pressão osmótica que deverá ser exercida para que a osmose não ocorra.
Essas informações são muito importantes em nosso cotidiano. Por exemplo, o soro fisiológico deve ter a mesma pressão osmótica que o sangue (aproximadamente 7,7 atm), ou seja, deve ser isotônico em relação ao sangue. Caso contrário, sérios danos poderiam ser causados ao organismo.
Se o soro fosse hipertônico em relação ao sangue, isto é, se sua concentração e pressão osmótica fossem maiores que as do sangue, os glóbulos vermelhos murchariam, pois perderiam água, que seria “sugada” para o lado de fora. Por outro lado, se o soro fosse hipotônico em relação ao sangue (se sua concentração e pressão osmótica fossem menores que as do sangue), a água passaria a entrar dentro dos glóbulos vermelhos e elas inchariam, podendo até estourar, o que é conhecido como hemólise.
Na natureza, esses conceitos também são vistos. Por exemplo, você já se perguntou como a água consegue vencer a barreira da gravidade e chegar até o topo de árvores muito altas? Isso é possível porque a pressão osmótica nas raízes das plantas pode atingir valores bem altos, o que permite que a água movimente-se através de todas as regiões da planta.

A pressão osmótica das raízes das árvores permite que a água chegue até as suas partes mais elevadas
Visto que a pressão osmótica muda de acordo com a concentração da solução, como podemos calcular qual é o seu valor?
Bem, isso foi determinado pelo físico e químico holandês Jacobus Henricus Van’t Hoff (1852-1911). Ele observou que a pressão osmótica dependia das mesmas variáveis que participam da Equação de Estado dos Gases (Equação de Clapeyron). Veja como isso é verdade: sabemos que a pressão osmótica depende daconcentração em quantidade de matéria (em mol/L), que é dada por:
Concentração em quantidade de matéria (mol/L) = quantidade de matéria do soluto (mol)
volume da solução (L)
volume da solução (L)
ou
M = n1
V
V
Além disso, a temperatura (T) também influencia na pressão osmótica. Observe que aparecem as seguintes grandezas: pressão (P), volume (V), quantidade de matéria (n) e temperatura (T), ou seja, as mesmas variáveis da equação de Clapeyron mostrada a seguir:
P . V = n . R . T
A pressão osmótica é simbolizada por π, assim, substituindo a pressão na equação acima, temos:
π . V = n . R . T
π = n . R . T
V
V
Visto que M = n , podemos escrever essa equação da seguinte forma:
V
V
π = M . R . T
Lembrando que R é a constante universal dos gases perfeitos, cujo valor é 0,082 atm . L . K-1 . mol-1 ou 62,3 mmHg . L . K-1 . Mol-1. Essa é, então, a fórmula que pode ser usada para calcular a pressão osmótica (π) para soluções moleculares.
No caso de soluções iônicas, deve-se acrescentar o fator de Van't Hoff (i), que é a relação feita entre o número total de partículas finais em relação às iniciais nas soluções iônicas.
Por exemplo, se adicionarmos 1 mol de NaCl na água, teremos no final 1 mol de partículas de Na+ e 1 mol de partículas de Cl-, conforme mostra a equação de ionização do sal a seguir:
NaCl → Na+(aq)+ Cl-(aq)
1 mol → 1 mol + 1 mol } 2 mols
1 mol → 1 mol + 1 mol } 2 mols
Se o grau de ionização é de 100%, então o fator de Van't Hoff é igual a 2 nesse caso.
Assim, a equação fica do seguinte modo:
π = M . R . T . i
Veja um exemplo de como calcular a pressão osmótica:
Exemplo: Eventualmente, a solução de glicose 0,3 mol/L é utilizada em injeção intravenosa, pois tem pressão osmótica próxima à do sangue. Qual é a pressão osmótica, em atmosferas, dessa solução a 37ºC? Dado: R = 0,082 atm . L . K-1 . mol-1.
Resolução:
Dados:
M = 0,3 mol/L
R = 0,082 atm . L . K-1 . mol-1
T = 37ºC (temos que passar para graus kelvin, pois a constante universal dos gases perfeitos, R, está nessa unidade. Para tal, basta somar a temperatura em graus Celsius com 273) = 310 K.
Π = ?
Como é uma solução de glicose, ou seja, é uma solução molecular, não precisamos usar o fator de Van't Hoff. Assim, basta aplicar os valores dados na fórmula:
π = M . R . T
π = (0,3 mol/L). (0,082 atm . L . K-1 . mol-1) . (310 K)
π =7,63 atm
Por Jennifer Fogaça
Graduada em Química
http://manualdaquimica.uol.com.br/
Assinar:
Postagens (Atom)




