Solução-tampão no sangue humano
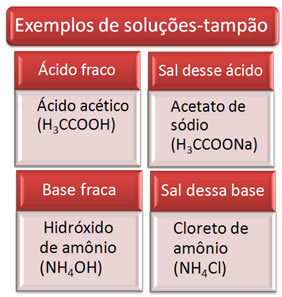
Solução-tampão é uma mistura que tem a capacidade de evitar que o pH da solução sofra grandes variações. É formada por um ácido ou base fraco, e um sal desse ácido ou base.
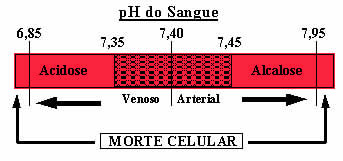
O sangue transportado pelo sistema circulatório é mantido com pH na faixa de 7,35 a 7,45, graças à ação de soluções-tampão
A solução-tampão é geralmente uma mistura de um ácido fraco com o sal desse ácido, ou uma base fraca com o sal dessa base. Essa solução tem por finalidade evitar que ocorram variações muito grandes no pH ou no pOH de uma solução.
A seguir temos alguns exemplos de soluções-tampão:
A eficácia da solução-tampão pode ser vista no nosso sangue, onde, mesmo com a adição de ácido ou base em pequenas quantidades ao plasma sanguíneo, praticamente não há alteração em seu pH.
Como isso ocorre, sendo que, se adicionarmos ácidos ou bases na água, seu pH muda rapidamente?
O sangue humano é um sistema-tampão ligeiramente básico, ou seja, é um líquido tamponado: seu pH permanece constante entre 7,35 e 7,45. Um dos tampões mais interessantes e importantes no sangue é formado pelo ácido carbônico (H2CO3) e pelo sal desse ácido, o bicarbonato de sódio (NaHCO3).
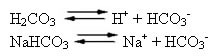
Assim, existem as seguintes espécies nessa solução-tampão:
H2CO3: presente em grande quantidade, pois, sendo um ácido fraco, sofre pouca ionização;
H+: proveniente da ionização do H2CO3;
HCO3-: também presente em alta quantidade, proveniente da ionização do H2CO3e da dissociação do sal (NaHCO3);
Na+: proveniente da ionização do NaHCO3;
H+: proveniente da ionização do H2CO3;
HCO3-: também presente em alta quantidade, proveniente da ionização do H2CO3e da dissociação do sal (NaHCO3);
Na+: proveniente da ionização do NaHCO3;
Se a essa solução for adicionada uma pequena concentração de ácido, irá ocorrer sua ionização, gerando cátions H+, que irão reagir com os ânions HCO3-presentes no meio, originando ácido carbônico não ionizado. Não ocorre a variação do pH.
Já se uma base for adicionada, serão gerados ânions OH-. Esses íons se combinam com os cátions H+, provenientes da ionização do H2CO3. Assim, os ânions OH- são neutralizados, mantendo o pH do meio.
Além dessa solução-tampão citada, há também outras duas presentes no sangue, que são: H2PO4/HPO42- e algumas proteínas. Se não houvesse essas soluções-tampão no sangue, a faixa de pH poderia sofrer sérios desvios. Se o pH do sangue subir, sendo superior a 7,8, denomina-se alcalose. Já se o pH cair demais, abaixo de 6,8, será um estado de acidose. Ambas são condições perigosas, que podem levar à morte.
BrasilEScola

Nenhum comentário:
Postar um comentário