Abaixo estão representadas as geometrias moleculares mais importantes:
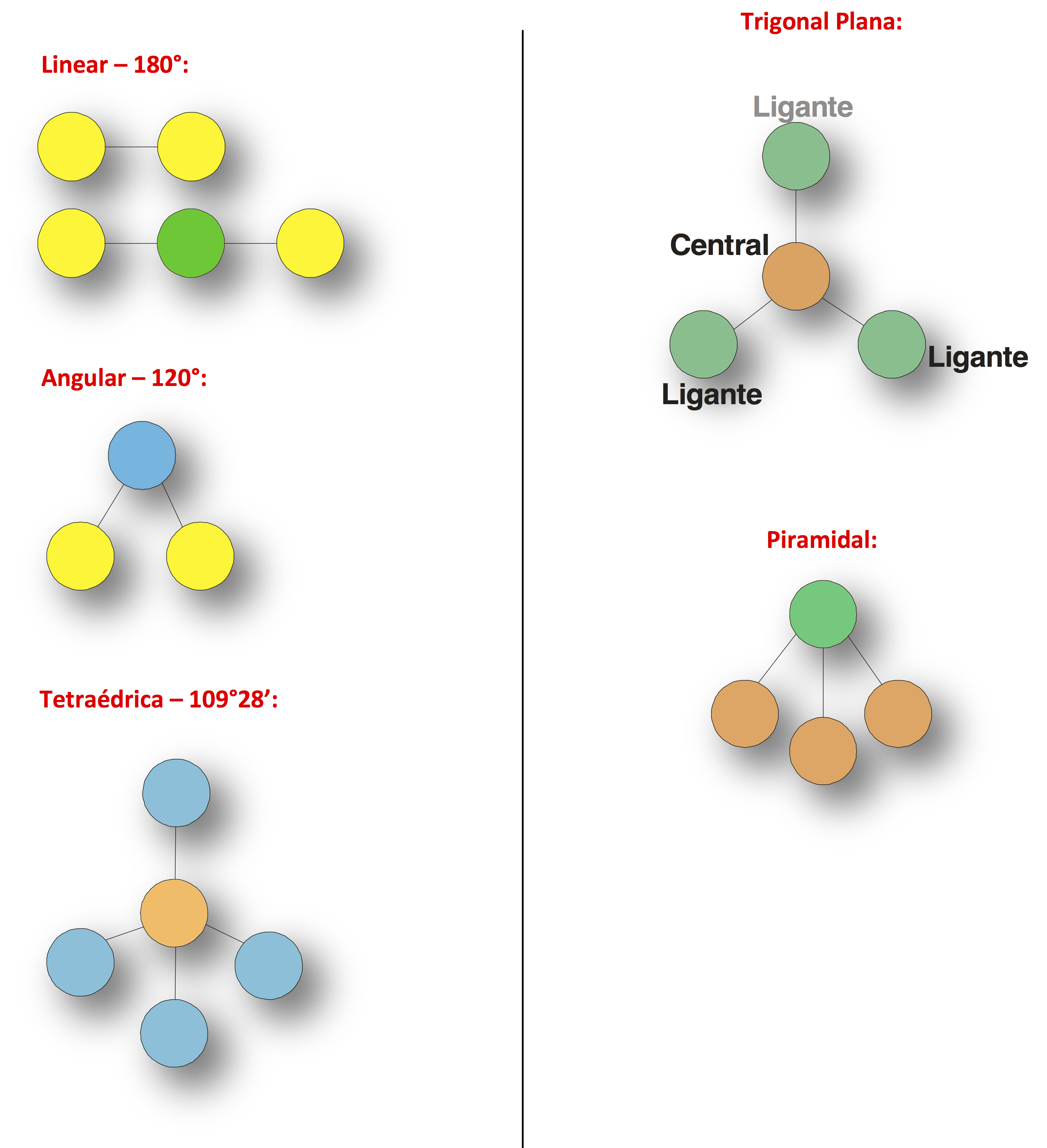
Observação: nas moléculas Lineares, Trigonais Planas e Tetraédricas não sobram elétrons no átomo central; nas Angulares e Piramidais sobram elétrons no átomo central.
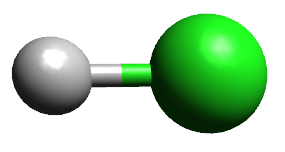
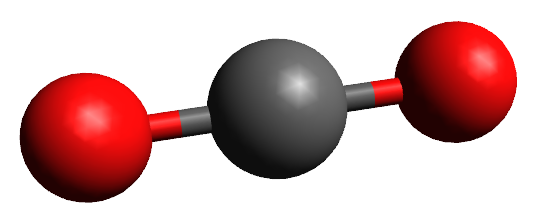
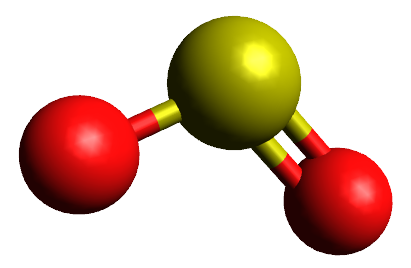
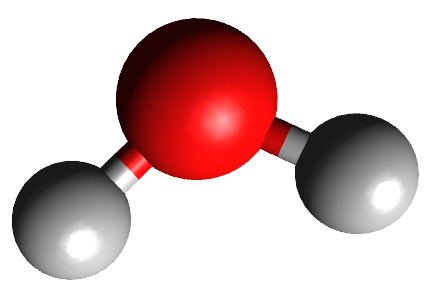
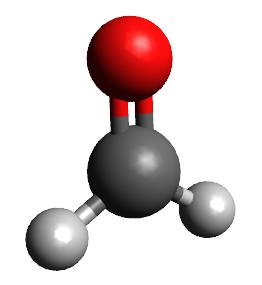
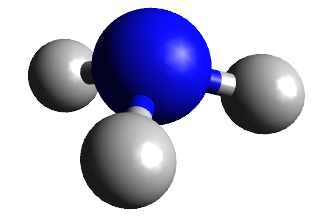
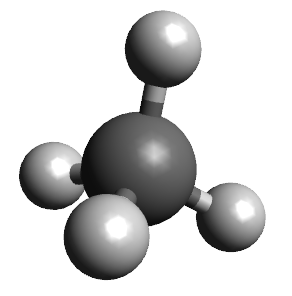
Teoria da repulsão dos pares de elétrons da camada de valência (TRPECV)
Para determinar a geometria de uma molécula, a TRPECV propõe uma sequência de passos: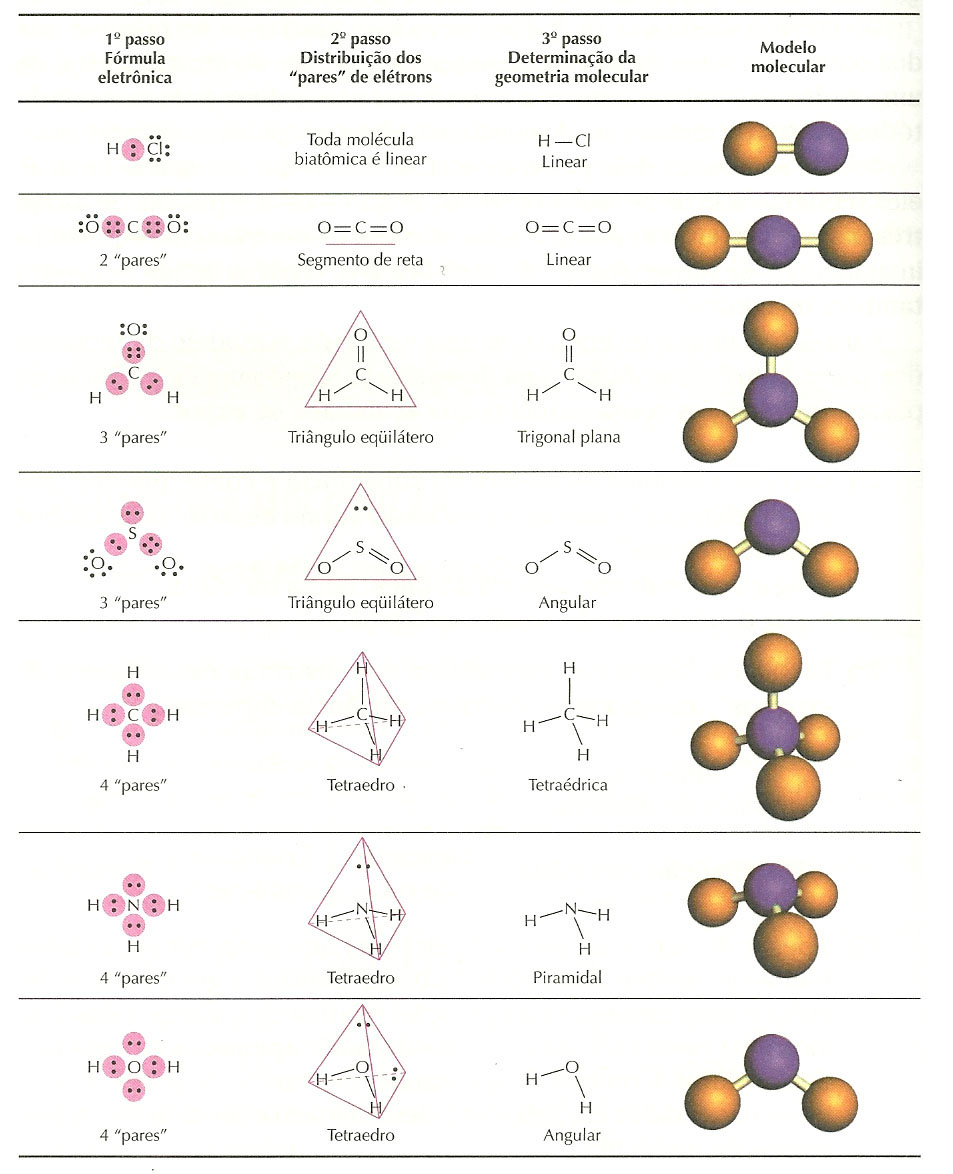
Polaridade de ligações
Os átomos dos diversos elementos químicos apresentam diferentes tendências para atrais elétrons.Denomina-se eletronegatividade a tendência que o átomo de um determinado elemento apresenta para atrair elétrons, num contexto em que se acha ligado a outro(s) átomo(s)[1]. Ordem de eletronegatividade:
Ligações polares e apolares
Tome por exemplo a molécula de HF. O par de elétrons compartilhado não é atraído igualmente por ambos os átomos, isso pois o flúor é mais eletronegativo que o hidrogênio. Embora o par de elétrons esteja sendo compartilhado, ele se encontra mais deslocado no sentido do flúor. Dizemos que no flúor aparece uma carga parcial negativa (δ–) e no hidrogênio uma carga parcial positiva (δ+). A ligação entre H e F é chamada de ligação covalente polar.Considere, agora, o caso da molécula de H2. Como ambos os átomos presentes nela possuem a mesma eletronegatividade, não há polarização da ligação e dizemos que se trata de uma ligação covalente apolar.
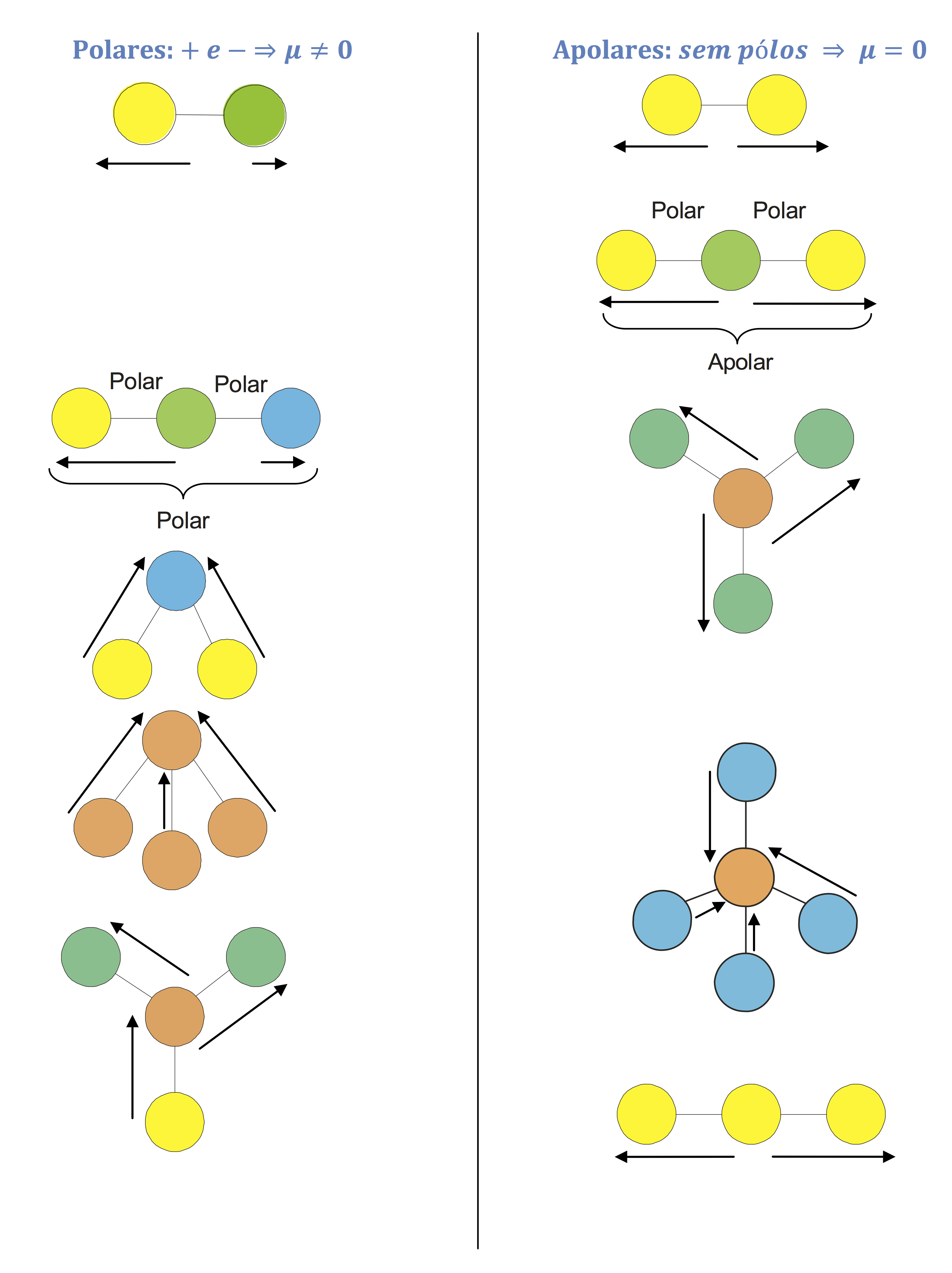
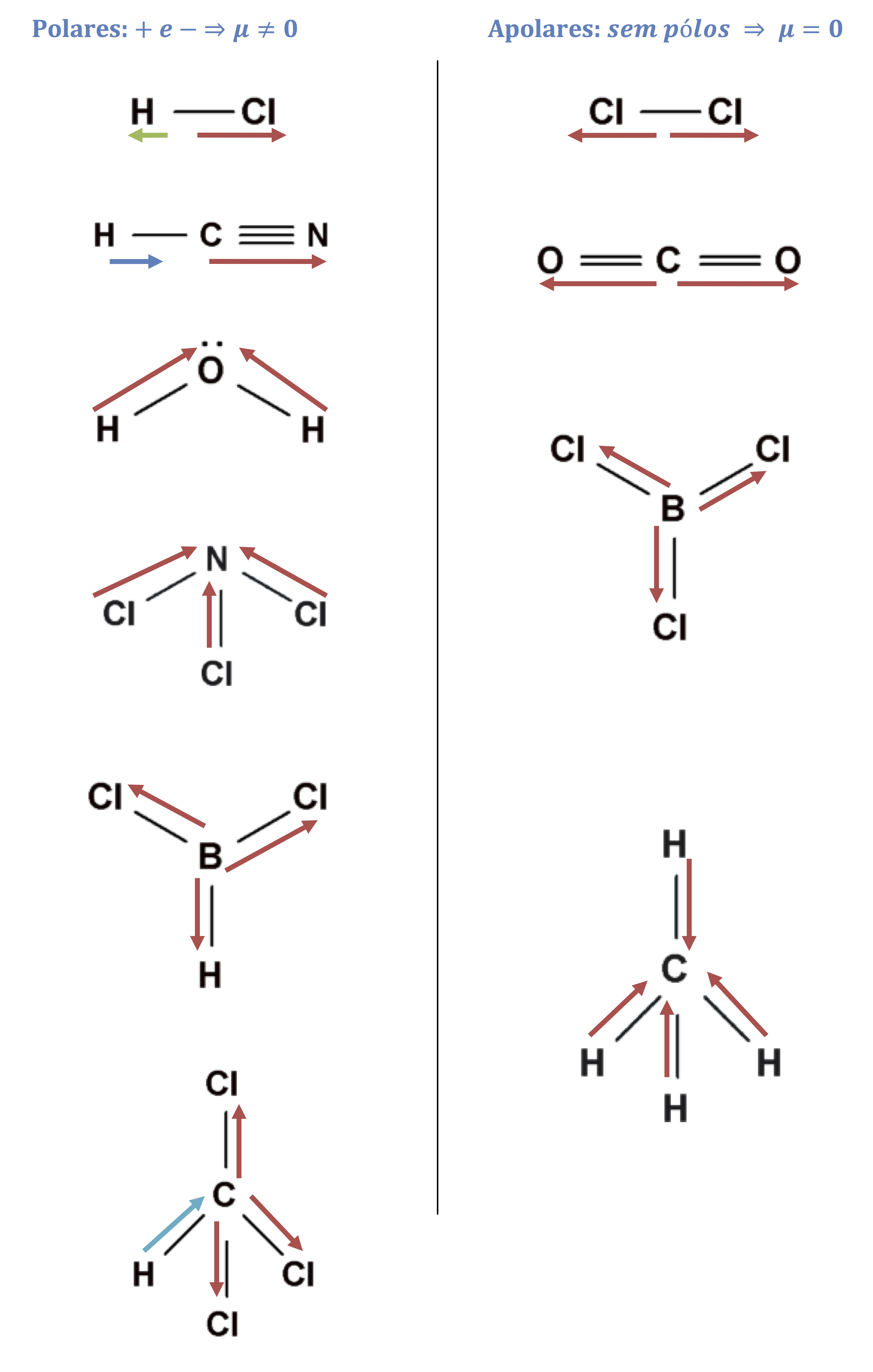
Polaridade de moléculas
Podemos representar a polarização de uma ligação covalente por um vetor momento de dipolo ou momento diplomar (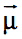 ). O vetor
). O vetor 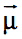 tem a direção da reta que passa pelo núcleo dos átomos que fazem parte da ligação considerada e é orientado no sentidos do pólo polo positivo para o negativo.
tem a direção da reta que passa pelo núcleo dos átomos que fazem parte da ligação considerada e é orientado no sentidos do pólo polo positivo para o negativo. As ligações apolares possuem vetor momento de dipolo nulo (
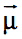 =0).
=0). No caso da análise de moléculas com mais de dois átomos, deve-se somar todos os vetores das ligações existentes e concluir se o vetor resultante (
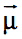 R) é nulo ou não. Se for nulo a molécula é apolar, caso contrário, é polar.
R) é nulo ou não. Se for nulo a molécula é apolar, caso contrário, é polar. 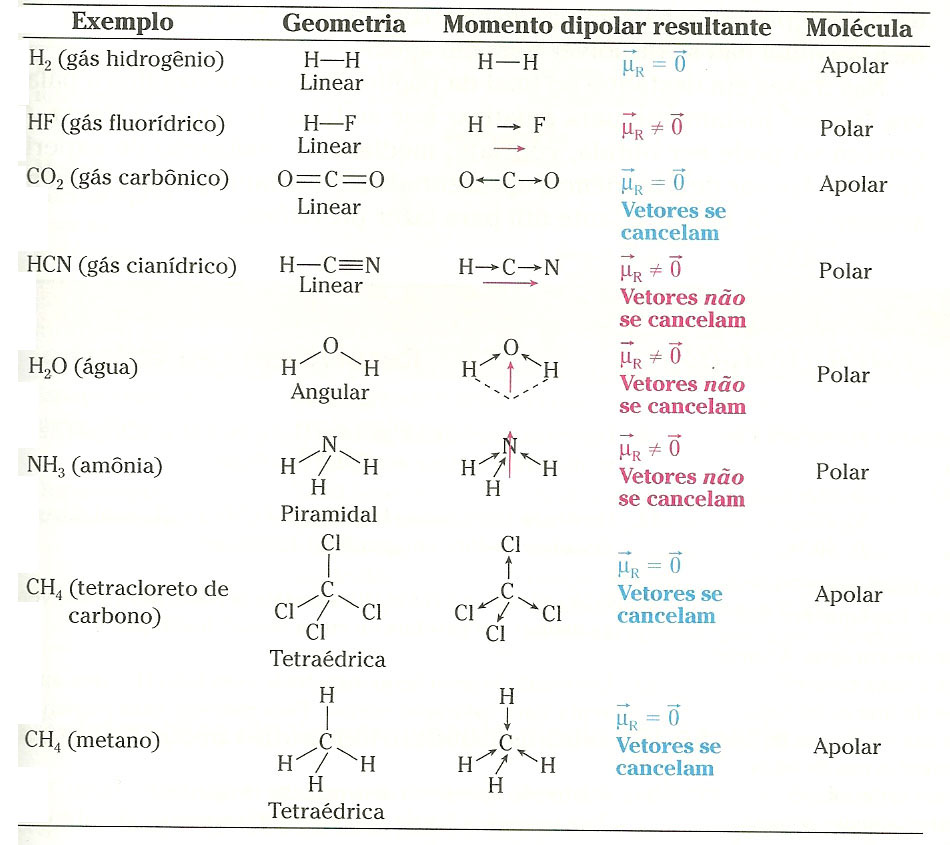

Nenhum comentário:
Postar um comentário